پتاسیم پرمنگنات
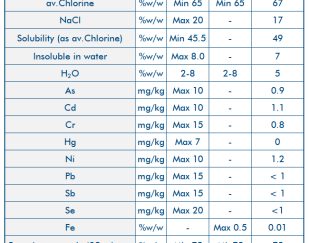
پتاسیم پرمنگنات پرمنگنات پتاسیم یک ترکیب معدنی با فرمول شیمیایی KMnO4 است و از K + و MnO4− تشکیل شده است.
این ماده جامد کریستالی سیاه و سفید است که در آب حل می شود تا محلول هایی به شدت صورتی یا بنفش به وجود آورد.
پرمنگنات پتاسیم به طور گسترده در صنایع شیمیایی و آزمایشگاهها .
به عنوان یک ماده اکسید کننده قوی و همچنین به عنوان دارویی برای درماتیت ، برای تمیز کردن زخم ها و ضد عفونی عمومی مورد استفاده قرار می گیرد.
این در لیست مدل WHO از داروهای ضروری ، ایمن ترین و موثرترین داروهای مورد نیاز در یک سیستم بهداشتی است.
در سال 2000 ، تولید جهانی 30،000 تن تخمین زده شد.
ساختار:
KMnO4 کریستالهای ارتورمبیک را با ثابت تشکیل می دهد: a = 910.5 بعد از ظهر ، b = 572.0 بعد از ظهر ، c = 742.5 بعد از ظهر.
نقوش کلی شبیه به سولفات باریم است .
که با آن محلول های جامد تشکیل می دهد. [34] در جامد (مانند محلول) ، هر مرکز MnO4− چهار ضلعی است. مسافت منگنز 1.62 است.
خرید پتاسیم پرمنگنات
برای خرید پتاسیم پرمنگنات میتوانید یا از طریق شماره ما با ما تماس بگیرید.
یا از طریق لینک زیر سفارش دهید تا قیمت روز پتاسیم پرمنگنات را در هر مقدار برای شما ارسال کنیم

تاریخ کشف و نحوه پیدایش Potassium permanganate :
در سال 1659 ، یوهان رودولف گلابر مخلوطی از پیرولوزیت معدنی (دی اکسید منگنز ، MnO2) و کربنات پتاسیم .
را برای دستیابی به ماده ای که هنگام حل شدن در آب ، محلول سبز (منگنات پتاسیم) داد که به آرامی به بنفشه تغییر یافت.
و سپس سرانجام قرمز شد. .
این گزارش اولین توصیف تولید پرمنگنات پتاسیم را نشان می دهد.
کمی بعد از گذشت 200 سال ، شیمیایی لندن ، هنری بولمان کاندی ، علاقه ای به ضدعفونی کننده ها داشت.
وی دریافت که ذوب پیرولوزیت با هیدروکسید سدیم (NaOH) و حل کردن آن در آب ، محلول با خواص ضد عفونی کننده تولید می کند.
او این راه حل را به ثبت رساند و آن را با نام “سیال Condy’s” به بازار عرضه کرد. اگرچه مؤثر است ، اما راه حل بسیار پایدار نبود.
این با استفاده از هیدروکسید پتاسیم (KOH) به جای NaOH غلبه کرد.
این با ثبات تر بود و از مزیت تبدیل آسان به بلورهای پرمنگنات پتاسیم به همان اندازه مؤثر برخوردار بود.
این ماده بلوری به عنوان “بلورهای Condy” یا “پودر Condy” شناخته می شد.
پرمنگنات پتاسیم برای تولید نسبتاً آسان بود ، بنابراین متعاقباً کاندی مجبور شد زمان قابل توجهی را در دادرسی صرف کند تا رقبا را از بازاریابی محصولات مشابه باز دارد.
عکاسان اولیه از آن به عنوان یک جزء پودر فلش استفاده می کردند.
اکنون به دلیل بی ثباتی مخلوط های پرمنگنات ، جایگزین آن با اکسید کننده های دیگر شده است.
کاربرد های پتاسیم پرمنگنات :
تقریباً اکثر صنایع از کاربردهای اکسید کننده آن بهره برداری می کنند.
KMnO4 به عنوان یک اکسیدان قوی که باعث تولید فرآورده های سمی نمی شود و دارای کاربردهای بسیار منحصر به فرد است.
استفاده در پزشکی
پرمنگنات پتاسیم برای تعدادی از بیماری های پوستی استفاده می شود.
این شامل عفونت های قارچی کف پا ، سرکه پا ، پمفیگوس ، زخم های سطحی ، درماتیت و زخم های گرمسیری است.
در این لیست داروهای ضروری سازمان بهداشت جهانی ، از ایمن ترین و موثرترین داروهای موثر در یک سیستم بهداشتی است.
استفاده در تصفیه آب:
پرمنگنات پتاسیم در صنعت تصفیه آب کاربرد گسترده ای دارد.
این ماده به عنوان یک ماده شیمیایی احیا کننده برای از بین بردن آهن و سولفید هیدروژن (بو بوی تخم مرغ فاسد شده) از چاه آب از طریق فیلتر “منگنز Greensand” استفاده می شود.
“Pot-Perm” همچنین در فروشگاههای استخر قابل تهیه است و علاوه بر این برای تصفیه فاضلاب نیز استفاده می شود.
از لحاظ تاریخی از آن برای ضد عفونی کردن آب آشامیدنی استفاده شده بود .
و می تواند آب را صورتی رنگ کند. در حال حاضر این نرم افزار در کنترل موجودات مزاحم مانند صدف های گورخر در سیستم های جمع آوری و تصفیه آب شیرین کاربرد دارد.
آزمایش خمیر دندان فیل
در آزمایش خمیر دندان فیل با استفاده از اختلاط آب اکسیژنه و پتاسیم پرمنگنات یا پتاسیم یدید آزمایشی.
بسیار جذاب برای کودکان و حتی بزرگسالان انجام میدهند که روش انجام آن را ما در فیلم زیر برای شما آماده کرده ایم
اطلاعاتی جامع در تصفیه آب با پتاسیم پرمنگنات:
پرمنگنات پتاسیم یک گزینه تصفیه آب ورودی است. به عنوان جامد خشک و بنفش رنگ به فروش می رسد.
بیت های محلول آهن ، سولفید هیدروژن و منگنز را اکسیده می کند تا ذرات جامد به راحتی از آب فیلتر شوند.
لازم به ذکر است که پرمنگنات پتاسیم ضد عفونی کننده خوبی نیست.
شما همچنین نمی خواهید مقدار زیادی از پرمنگنات باقی بماند زیرا احتمالاً رنگ صورتی به آب می دهد که هیچ کس نمی خواهد از لوله های آنها بیرون بیاید.
چرا پرمنگنات پتاسیم مفید است؟
کاربردهای زیادی برای پرمنگنات پتاسیم وجود دارد. بیشتر از آن به عنوان پیش درمانی استفاده می شود.
بهتر است از بوی سولفید خلاص شوید تا کلر. پرمنگنات پتاسیم اغلب برای کنترل طعم و بو ، از بین بردن رنگ ، کنترل رشد
بیولوژیکی در کارخانه های تصفیه، ساختارهای ورودی و خطوط لوله استفاده می شود.
پرمنگنات پتاسیم در چاه ها برای کنترل باکتری های آهن و سایر رشد بیولوژیکی استفاده می شود.
همچنین طعم چربی آب را حفظ می کند و بوی آن را کنترل می کند.
چگونه پرمنگنات پتاسیم کار می کند ؟
به طور کلی ، یک دستگاه پرمنگنات پتاسیم را درون آب بین پمپ و مخزن نگهدارنده تزریق می کند.
هنگام درمان چاه ، غلظت 3.8 تا 7.6 گرم در هر گالن به از بین بردن باکتری های آهن کمک می کند. بعد از اینکه مخلوط درون چاه تغذیه شد ، آشفتگی باعث درمان بهتر می شود.
با روشن و خاموش کردن آن می توانید چاه را بهم زنید. این آب را مجبور می کند تا از درون محفظه بیرون بیاید و سپس اسپل را به پایین برگرداند.
در طی فرآیندهای تصفیه آب در مقیاس بزرگ ، پرمنگنات پتاسیم معمولاً در اوایل زمان مصرف آب خام اضافه می شود.
پس از اکسیداسیون پرمنگنات ، می توان از ضد عفونی کلر ، کربن فعال شده دانه ای (GAC) یا تصفیه غشایی استفاده کرد.
همچنین می تواند همزمان با انعقادها در مخزن مخلوط سریع اضافه شود. پرمنگنات پتاسیم همیشه قبل از تصفیه اضافه می شود.
مراحل تصفیه آب پرمنگنات پتاسیم :
به منظور استفاده موفقیت آمیز از تصفیه آب پرمنگانات پتاسیم ، سه مرحله ساده وجود دارد.
مرحله 1:
ابتدا یک آزمایش نمونه آب انجام دهید تا pH ، درجه حرارت ، منگنز و آهن آب بررسی شود.
نظارت بر pH آب برای انجام همه زمانها مهم است.
برای اکسیداسیون به 0.94 میلی گرم پرمنگنات پتاسیم در هر میلی گرم آهن و 1.92 میلی گرم در هر میلی گرم منگنز نیاز دارید.
هنگام استفاده از آب برای بو و طعم ، دستورالعمل سازنده را برای دوز دنبال کنید.
اگر نمی خواهید دوز را محاسبه کنید ، می توانید قرص های پیش ساخته را نیز خریداری کنید.
گام 2:
بعد ، آب آشامیدنی را فیلتر کنید تا دی اکسید منگنز و رسوب گوگرد عنصری از بین برود.
ممکن است بخواهید این روش درمانی را با سیستم بستر رزینی “greensand” جفت کنید.
مرحله 3:
پرمنگنات پتاسیم باقی مانده خود را در یک ظرف محکم هوا نگه دارید.
آن را در محلی خشک و خنک نگهداری کنید که به خوبی از اسیدها ، پراکسیدها و مواد قابل احتراق و اکسید کننده فاصله نداشته باشد.
سنتز ترکیبات آلی :
کاربرد اصلی KMnO4 به عنوان معرف برای سنتز ترکیبات آلی است.
مقادیر قابل توجهی برای سنتز اسید اسکوربیک ، کلرامفنیکول ، ساکارین ، اسید ایزونیکوتنیک و اسید پیرازینوئیک مورد نیاز است.
KMnO4 در آنالیز ارگانیک کیفی برای آزمایش حضور اشباع استفاده می شود.
این ماده بعضاً بعنوان ماده شیمیایی ارگانیک آلمانی آدولف فون باایر به عنوان معرف بایایر گفته می شود.
معرف یک محلول قلیایی پرمنگنات پتاسیم است.
واکنش با اوراق قرضه دو یا سه برابر (-C = C- یا -C≡C) باعث می شود رنگ از بنفش-صورتی تا قهوه ای محو شود.
آلدهیدها و اسید فرمیک (و فرمیات) نیز آزمایش مثبتی ارائه می دهند. این تست قدیمی است.
از پرمنگنات پتاسیم می توان برای تعیین کمی ماده آلی اکسید کننده کل در یک نمونه آبی استفاده کرد.
مقدار تعیین شده به عنوان مقدار پرمنگنات شناخته می شود.
در شیمی تحلیلی ، یک محلول آبی استاندارد KMnO4 گاه به عنوان یک عنصر اکسید کننده برای تیترهای ردوکس (پرنگنگومتری) استفاده می شود.
همانطور که تیتراژ پرمنگنات پتاسیم است ، محلول به یک سایه روشن از مژگان تبدیل می شود .
که با افزودن اضافی تیتراژ به محلول تیره می شود. به روش مرتبط ، از آن به عنوان معرف برای تعیین تعداد كپا از خمیر چوب استفاده می شود. برای استانداردسازی محلول های KMnO4 ، از کاهش اسید اگزالیک اغلب استفاده می شود.
محلولهای اسیدی و آبی اسید KMnO4 برای جمع آوری جیوه های گازی موجود در گازهای دودکش در آزمایش انتشار منبع ثابت استفاده می شود.
در بافت شناسی ، از پرمنگنات پتاسیم به عنوان ماده سفید کننده استفاده شد.
حفظ میوه با پتاسیم پرمنگنات
جاذب های اتیلن زمان ذخیره موز را حتی در دماهای بالا افزایش می دهند.
این اثر با بسته بندی موز در پلی اتیلن به همراه پرمنگنات پتاسیم قابل بهره برداری است.
با از بین بردن اتیلن توسط اکسیداسیون ، پرمنگنات باعث تاخیر در رسیدن می شود و ماندگاری میوه را تا 4 هفته بدون نیاز به یخچال افزایش می دهد.
کیت های بقا :
پرمنگنات پتاسیم به طور معمول در کیت های بقا گنجانده شده است:
به عنوان یک استارت آتش سوزی قند خون (استناد مورد نیاز) (مخلوط ضد یخ از رادیاتور ماشین یا گلیسرول و پرمنگنات پتاسیم) ، دستگاه ضدعفونی آب و برای ایجاد سیگنال های پریشانی برف.
خدمات آتش نشانی
پرمنگنات پتاسیم برای ایجاد آتش سوزی ، فرسودگی و سوختگی کنترل شده به “دیافراگمهای کره پلاستیکی” اضافه می شود.
حوزه های پلیمری شبیه توپ های پینگ پنگ که حاوی مقادیر کمی پرمنگنات هستند.
با اتیلن گلیکول تزریق می شوند و به سمت منطقه مورد نظر احتراق پیش بینی می شوند ،.
جایی که چند ثانیه بعد خود به خود مشتعل می شوند. از هر دو دستگیره و هلیکوپتر یا قایق سواری استفاده شده است.
استفاده های دیگر
پرمنگنات پتاسیم یکی از مواد شیمیایی اصلی است که در صنایع فیلم و تلویزیون برای “سن” غرفه ها و تنظیم پانسمان استفاده می شود. تبدیل آماده آن به MnO2 قهوه ای ، ظاهری “صد ساله” یا “باستانی” را بر روی پارچه Hessian (چاقو) ، طناب ، چوب و شیشه ایجاد می کند.
در شیمی کشاورزی برای تخمین نیتروژن موجود در خاک استفاده می شود.
آماده سازی
پرمنگنات پتاسیم بصورت صنعتی از دی اکسید منگنز تولید می شود .
که به عنوان پیرولوزیت معدنی نیز رخ می دهد. در سال 2000 ، تولید جهانی 30،000 تن تخمین زده شد.
MnO2 با هیدروکسید پتاسیم ترکیب می شود و در هوا یا با منبع اکسیژن دیگری مانند نیترات پتاسیم یا کلرات پتاسیم گرم می شود.
این فرآیند به منگنات پتاسیم می دهد:
MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O2
(در رابطه با هیدروکسید سدیم ، محصول نهایی منگنات سدیم نیست بلکه یک ترکیب منگنز (V) است ،.
که یکی از دلایلی است که پرمنگنات پتاسیم بیشتر از پرمنگنات سدیم استفاده می شود. علاوه بر این ، نمک پتاسیم بهتر تبلور می یابد.
سپس منگنات پتاسیم با اکسیداسیون الکترولیت در محیط قلیایی به پرمنگنات تبدیل می شود:
K2MnO4 + 2 H2O → 2 KMnO4 + 2 KOH + H22
روش های دیگر
اگرچه از اهمیت تجاری برخوردار نیست ، منگنات پتاسیم توسط کلر یا عدم تناسب در شرایط اسید قابل اکسیداسیون است.
واکنش اکسیداسیون کلر است
K2MnO4 + Cl2 → 2 KMnO4 + 2 KCl2
و ممکن است واکنش نامتناسب ناشی از اسید نوشته شود
K2MnO4 + 4 HCl → 2 KMnO4 + MnO2 + 2 H2O + 4 KCl3
یک اسید ضعیف مانند اسید کربنیک برای این واکنش کافی است:
2 K2MnO4 + 2 CO2 → 2 KMnO4 + 2 K2CO3 + MnO 3
نمک های پرمنگنات همچنین با درمان محلول یون های منگنز + با اکسیدان های قوی مانند دی اکسید سرب (PbO2) ، بیسموتات سدیم (NaBiO3) یا پراکسیدیزولفات تولید می شود.
آزمایشات وجود منگنز از رنگ بنفش زنده پرمنگنات تولید شده توسط این معرفها بهره برداری می کند.
شیمی آلی واکنش های پتاسیم پرمنگنات:
محلول های رقیق کننده KMnO4 آلکن ها را به دیول ها (گلیکول ها) تبدیل می کنند.
این رفتار همچنین به عنوان یک آزمایش کیفی برای حضور پیوندهای دو یا سه گانه در یک مولکول مورد استفاده قرار می گیرد .
زیرا واکنش محلول اولیه پرمنگنات بنفش را ابتدا تجزیه می کند و یک رسوب قهوه ای تولید می کند (MnO2).
در این زمینه ، گاهی اوقات واکنشگر بایایر نامیده می شود.
با این حال ، برم در اندازه گیری کمی اشباع (اوراق قرضه دو یا سه برابر) کمی بهتر عمل می کند .
از آنجا که KMnO4 ، یک عامل اکسید کننده بسیار قوی است ، می تواند با گروه های مختلفی واکنش نشان دهد.
در شرایط اسیدی ، پیوند مضاعف آلکان شکسته می شود تا اسید کربوکسیلیک مناسب را به دست دهد: [36]
CH3 (CH2) 17CH = CH2 + 2 KMnO4 + 3 H2SO4 → CH3 (CH2) 17COOH + CO2 + 4 H2O + K2SO4 + 2 MnSO4
پرمنگنات پتاسیم آلدهیدها را به اسیدهای کربوکسیلیک اکسید می کند ، مانند تبدیل n-heptanal به اسید هپتانوئیک:
C6H13CHO + 2 KMnO4 + 3 H2SO4 → 5 C6H13COOH + 3 H2O + K2SO4 + 2 MnSO4
حتی یک گروه آلکیل (با یک هیدروژن بنزیلی) در حلقه معطر ، به عنوان مثال اکسیده می شود. تولوئن به اسید بنزوئیک.
5 C6H5CH3 + 6 KMnO4 + 9 H2SO4 → 5 C6H5COOH + 14 H2O + 3 K2SO4 + 6 MnSO4
گلیکولها و پلیولها نسبت به KMnO4 بسیار واکنش پذیر هستند.
به عنوان مثال ، افزودن پرمنگنات پتاسیم به محلول آبی شکر و هیدروکسید سدیم ، واکنش آفتابگردان شیمیایی را ایجاد می کند.
که شامل تغییر رنگ چشمگیر همراه با حالت های مختلف اکسیداسیون منگنز است.
یک واکنش جدی مرتبط به عنوان یک شروع کننده آتش در کیت های بقا مورد سوء استفاده قرار می گیرد.
به عنوان مثال ، مخلوطی از پرمنگنات پتاسیم و گلیسرول یا گلوکز پودر شده به راحتی مشتعل می شود.
خاصیت استریل کننده آن یکی دیگر از دلایل ورود KMnO4 در کیت بقا است.
به خودی خود ، پرمنگنات پتاسیم در بسیاری از حلالهای آلی حل نمی شود. اگر یک محلول ارگانیک از پرمنگنات مورد نظر باشد ، ممکن است .
“بنزن بنفش” تهیه شود ، یا با درمان مخلوط دو فاز از پرمنگنات پتاسیم آبی و بنزن با نمک آمونیوم کواترنر ، یا با توالی کاتیون پتاسیم با اتر تاج.
واکنش با اسیدها
واکنش پرمنگنات با اسید هیدروکلریک متمرکز به کلر می دهد. محصولات حاوی منگنز از واکنش های ردوکس به pH بستگی دارد.
محلولهای اسیدی پرمنگنات به یون منگنز صورتی (II) منیزیم (Mn2) و آب کاهش می یابد.
در محلول خنثی ، پرمنگنات فقط با سه الکترون کاهش می یابد تا دی اکسید منگنز (MnO2) به دست آید ، که در آن منگنز در حالت اکسیداسیون +4 است.
این ماده ای است که هنگام دست زدن به KMnO4 پوست فرد را لکه دار می کند.
KMnO4 به طور خودجوش در یک محلول قلیایی به K2MnO4 سبز کاهش می یابد ، که در آن منگنز در حالت اکسیداسیون 6+ قرار دارد.
یک واکنش کنجکاو پس از افزودن اسید سولفوریک غلیظ به پرمنگنات پتاسیم رخ می دهد.
اسید سولفوریک غلیظ با KMnO4 واکنش نشان می دهد و به Mn2O7 می دهد ، که می تواند انفجاری باشد.
اگرچه هیچ واکنشی ممکن است آشکار نباشد ، بخار روی مخلوط کاغذ آغشته به الکل را مشتعل می کند.
پرمنگنات پتاسیم و اسید سولفوریک برای تولید مقداری ازن واکنش نشان می دهند.
که قدرت اکسید کننده بالایی دارد و الکل را به سرعت اکسید می کند و باعث احتراق آن می شود.
از آنجایی که این واکنش Mn2O7 منفجره نیز ایجاد می کند ، باید این کار را فقط با احتیاط انجام داد.
تجزیه حرارتی
پرمنگنات پتاسیم جامد هنگام گرم شدن تجزیه می شود:
KMnO4 → K2MnO4 + MnO2 (s) + O22
در اینجا ، وضعیت اکسیداسیون منگنز به عنوان منگنز پتاسیم.
(حالت اکسیداسیون +7) به منگنات پتاسیم (حالت اکسیداسیون +6) و دی اکسید منگنز (حالت اکسیداسیون +4) تجزیه می شود.
گاز اکسیژن نیز آزاد می شود.